Алкины
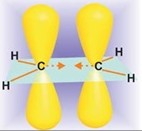
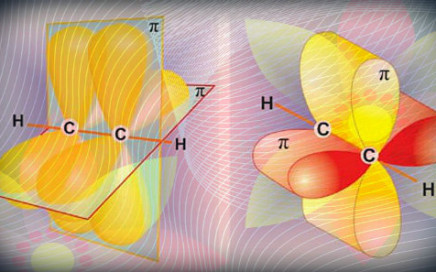
Алкины (или ацетиленовые углеводороды) — это непредельные углеводороды, содержащие тройную углерод-углеродную связь. Алкины имеют общую формулу CnH2n-2. Строение простейшего из них – ацетилена – приведено ниже. Ацетилен (этин) имеет линейное строение с очень коротким расстоянием 1,203 Å между ядрами двух атомов углерода: Связь С-Н также короче чем связь С-Н в этилене и этане. Все структурные […]