При рассмотрении селективности галогенирования алканов в предыдущем разделе было установлено, что для всех галогенов скорость замещения водорода у углеродного атома понижается в ряду третичный > вторичный > первичный, который прямо противоположен ряду энергий C – H-связей в алканах.
При сравнении энергий первичной и вторичной связей C – H в пропане видно, что они отличаются на 3 ккал/моль. Поскольку исходное соединение и один из радикалов H• одни и те же, эта разница отражает только различие в стабильности первичного и вторичного радикалов. Подобное же различие в энергии диссоциации изобутана (CH3)3CH на (CH3)2CH-CH2• и H• (98 ккал/моль) и его же диссоциации на (CH3)3C• и H• (92 ккал/моль) отражает различие в стабильности первичного и третичного радикалов. На основании этих данных можно составить ряд относительной стабильности алкильных радикалов: стабильность алкильных радикалов понижается в ряду третичный > вторичный > первичный. Еще более высокой стабильностью обладают аллильный и бензильный радикалы, тогда как фенильный и винильный радикалы менее стабильны, чем метил-радикал:
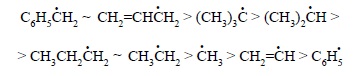
Изменение в стабильности алкильных радикалов обычно связывают с совместным действием двух эффектов – гиперконъюгации и стерического. Если с радикальным центром связан заместитель, обладающий мезомерным эффектом, то стабильность алкильного радикала в заметной степени возрастает. При этом радикал стабилизируется как сильными π-донорными (например, — NH2), так и сильными π-акцепторными (например, — BH2) группами, а также заместителями, облегчающими делокализацию неспаренного электрона (например, — CH=CH2) в аллильном радикале. На стабильность алкильных радикалов влияют также пространственнные факторы. Простые алкильные радикалы являются почти плоскими частицами, в которых неспаренный электрон занимает почти негибридизованную p-орбиталь.
Например, в трет-бутильном радикале метильные группы отклоняются от плоскости всего на 20º. Следовательно, пространственное отталкивание между заполненными электронными оболочками трех метильных групп в изобутане будет в значительной степени ослабляться при диссоциации связи C – H:
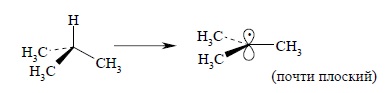
Если в качестве меры стабильности алкильного радикала мы выберем энергию диссоциации связи C – H в алканах, то указанный пространственный эффект будет дополнительно к гиперконъюгации стабилизировать трет-бутильный радикал по сравнению с метильным.
Обычно для свободных алкильных радикалов характерны реакции димеризации или диспропорционирования до алкана и алкена. Например:
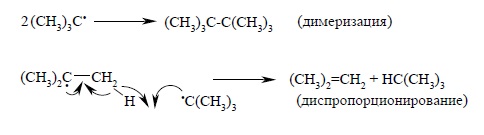
Поскольку обе реакции бимолекулярные, пространственные препятствия в них должны играть существенную роль. Поэтому разветвленные алкильные радикалы будут менее склонны к гибели и в этих реакциях.


