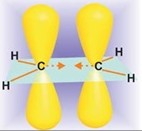
Эта реакция была открыта Г. Брауном сравнительно недавно, в 1959 г., тем не менее в настоящее время она приобрела очень большое значение в органическом синтезе, особенно в многостадийных синтезах биологически активных природных соединений: витаминов, феромонов, лекарственных веществ и др. Гидроборирование алкенов представляет собой присоединение гидридов бора по двойной связи. Простейший гидрид бора, боран BH3, неизвестен. Это соединение является крайне нестабильной кислотой Льюиса с секстетом электронов у атома бора. Боран самопроизвольно димеризуется в более стабильный диборан. Диборан имеет необычную мостиковую структуру, характерную для электронодефицитных молекул. Мостиковая структура B2H6 является классическим примером двухэлектронной трехцентровой связи B – H …B.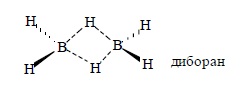
Четыре атома водорода и два атома бора диборана лежат в одной плоскости, а оба «мостиковых» атома водорода расположены над и под этой плоскостью. Диборан представляет собой бесцветный, ядовитый газ, мгновенно воспламеняющийся га воздухе, поэтому все реакции с ним следует проводить в инертной атмосфере. Диборан получают при взаимодействии боргидрида натрия и эфирата трехфтористого бора в ТГФ или диметиловом эфире этиленгликоля (диметоксиэтане – ДМЭ).![]()
Диборан как кислота Льюиса при взаимодействии с ТГФ или другим простым эфиром как основанием Льюиса образует донорно-акцепторный комплекс: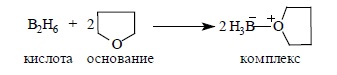
Этот комплекс легко отщепляет BH3, который быстро и количественно присоединяется к двойной связи алкена с образованием триалкилборана: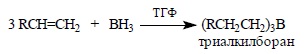
Гидроборирование включает три стадии. На первой стадии боран присоединяется к алкену с образованием моноалкилборана: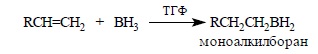
Моноалкилборан содержит две связи B – H, поэтому последовательно присоединяет еще две молекулы алкена: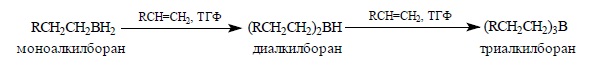
Присоединение борана к двойной связи происходит региоселективно против правила Марковникова таким образом, что атома бора оказывается связанным с наименее замещенным атомом углерода при двойной связи. Присоединение борана по двойной связи происходит стереоспецифично как син-присоединение с одновременным связыванием атома бора и водорода борана с двумя атомами углерода при двойной связи. Поэтому обе новые связи C – B и C – H образуются с одной и той же стороны кратной связи. Для этой реакции предложено четырехцентровое переходное состояние: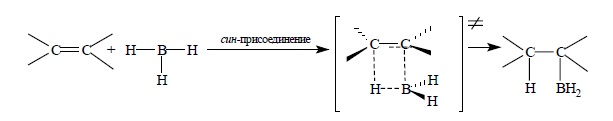
Региоселективность присоединения BH3 легко предсказать на основе как электронных, так и стерических факторов. Бор обладает меньшей электроотрицательностью (2,0) по сравнению с водородом (2,2), поэтому связь B – H должна быть слабополярной. Кроме того, атом бора в боране является электронодефицитным центром с пустой p-орбиталью, что определяет его электрофильные свойства. Радиус атома бора намного больше радиуса атома водорода. Поэтому стерический фактор также благоприятствует присоединению бора к наименее замещенному и доступному атому углерода. Полагают, что именное стерический фактор играет решающую роль, и направление присоединения борана к двойной связи определяется стерическим контролем реакции.
Монозамещенные алкены в реакции с бораном образуют триалкилбораны, однако для три- или тетраалкилзамещенных при двойной связи алкенов гидроборирование легко можно остановить на стадии образования моно- и диалкилборана. Особенно большое значение в органическом синтезе приобрел бис-(3-метил-2-бутил)-боран, образующийся при взаимодействии BH3 с двумя молекулами 3-метилбутена-2: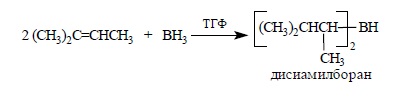
Этот реагент получил тривиальное название – дисиамилборан (Sia)2BH. Тетраметилэтилен образует с бораном аддукт состава 1:1 – 2,3-диметилбутил-2-боран, который называется тексилбораном: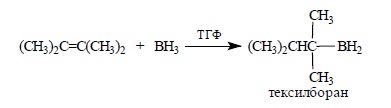
Син-присоединение борана к двойной связи проще всего может быть проиллюстрировано на примере гидроборирования 1-метилциклогексена с помощью BD3: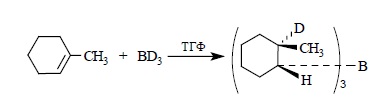
Алкилбораны, как правило, не выделяют индивидуально, а используют непосредственно для синтеза требуемого целевого продукта. Алкилбораны являются ключевыми реагентами для многих самых разнообразных превращений, большинство из которых было описано Г. Брауном с сотрудниками.
Связь углерод – бор в триалкилборанах под действием кислотных агентов расщепляется с образованием предельных углеводородов: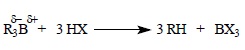
Так как карбоновые кислоты в этой реакции по своей реакционной способности превосходят более сильные кислоты (H2SO4, HCl, HBr и др.), для протолиза триалкилборанов был предложен механизм, включающий шестизвенное циклическое переходное состояние с нуклеофильной координацией карбонильного кислорода по атому бора и электрофильной атакой атома водорода недиссоциированной формы RCOOH по атому углерода триалкилборана: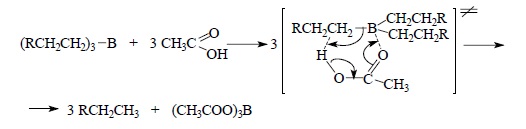
Этот метод особенно удобен в том случае, когда необходимо ввести изотопную дейтериевую метку в алкан. Тогда в качестве кислотного агента используют дейтероуксусную кислоту CH3COOD. В целом гидроборирование алкенов с последующим кислотным расщеплением триалкилборанов представляет собой легкодоступный и удобный способ превращения алкенов в алканы.
Гораздо более интересные и разнообразные синтетические возможности открывает расщепление триалкилборанов перекисью водорода или галогенами в щелочной среде. При обработке триалкилборанов щелочным раствором перекиси водорода происходит расщепление связи C – B с образованием спиртов. Таким образом, последовательность этих двух стадий гидрборирования алкенов представляет собой метод гидратации алкенов: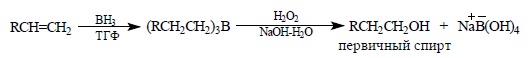
Гидроборирование несимметричных алкенов с последующим окислением H2O2 позволяет установить региоспецифичность и стереоспецифичность всего процесса. Так, например, при гидроборировании 1-метилциклогексена с последующим окислением триалкилборана щелочным раствором перекиси водорода образуется транс-2-метилциклогексанол. Это означает, что при окислении группа BR2 замещается на гидроксил с полным сохранением геометрической конфигурации. Направление гидратации алкена в этом двухстадийном процессе полностью противоположно региоселективности прямой гидратации алкенов или региоселективности оксимеркурирования – демеркурирования алкенов (разд. 5.4.3.е). Гидратация алкена, т.е. суммарный процесс гидроборирования – окисления, имеет ориентацию, прямо противоположную правилу Марковникова (антимарковниковское присоединение по кратной связи). Для циклических монозамещенных и дизамещенных алкенов гидроборирование – окисление дает уникальную возможность синтеза первичных спиртов с суммарным выходом 80 – 95%: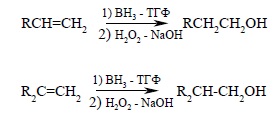
Для окислительного расщепления триалкилборанов в щелочной среде предложен следующий механизм превращений. Сначала гидропероксил-ион присоединяется к электронодефицитному атому бора триалкилборана: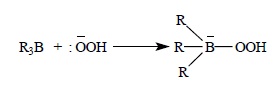
Образующийся при этом анионный боратный интермедиат претерпевает перегруппировку с потерей гидроксил-иона. Движущей силой этой перегруппировки является образование очень прочной связи B – O вместо менее прочной связи C – B: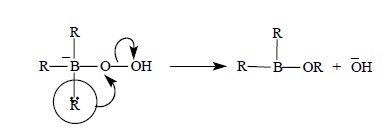
Более высокая прочность связи бора с кислородом определяется дополнительным перекрыванием заполненной 2p-орбитали кислорода с пустой 2p-орбиталью бора, стабилизирующим связь B – O. 1,2-Миграция алкильной группы с парой электронов от бора к кислороду, по существу, аналогична перегруппировке в карбокатионах, где также часто наблюдается стереоспецифическая 1,2-миграция алкильной группы с парой электронов к карбокатионному центру: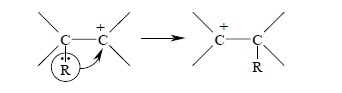
Первоначально образующийся продукт R2BOR подвергается далее окислительному расщеплению аналогично триалкилборану по описанной выше схеме с образованием эфира борной кислоты (триалкилбората):![]()
Триалкилборат в конечном итоге гидролизуется в щелочной среде до спирта и борат-аниона:![]()