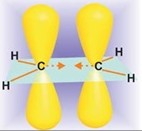
Алкены (олефины) — это углеводороды, содержащие одну двойную углерод-углеродную связь. Простейший алкен этилен (этен) имеет следующее геометрическое строение:

Молекула этилена плоская, с валентными углами, близкими к 120º. Это соответствует sp2-гибридизации обоих атомов углерода (гл. 1, разд. 1.8). В рамках модели гибридных орбиталей связи C – H образуются путем перекрывания sp2-гибридных АО углерода и 1s-орбиталей водорода. Однако, как было показано в гл. 2 (разд. 2.5.2), образование связей в молекуле этилена можно описать, не прибегая к гибридным орбиталям. Связь C – H в этилене (1,076Å) короче связи C – H в алканах (1,095Å), которая образована перекрыванием sp3-гибридной орбитали углерода и 1s-орбитали водорода. Это означает, что sp2-орбиталь более коротка и более электроотрицательная по сравнению с sp3-орбиталью атома углерода. Как уже было отмечено в гл. 2, σ-связь атомов углерода в этилене образуется за счет перекрывания двух эквивалентных sp2-гибридных орбиталей каждого из атомов углерода, тогда как π-связь возникает при перекрывании двух pz-орбиталей каждого из углеродных атомов. Эти орбитали параллельны, что обеспечивает максимальное перекрывание. В отличие от σ-связи π-связь имеет плоскость симметрии, совпадающую с плоскостью всей молекулы этилена.
σ-Электронная плотность связи C – C имеет цилиндрическую ось симметрии, тогда как π-электронная плотность имеет плоскость симметрии. Суммарное распределение электронной плотности между атомами углерода в этилене сильно отличается от того, которое можно представить только на основании σ-связи или π-связи, и не имеет цилиндрической ось симметрии, Важнейшим следствием отсутствия цилиндрической оси симметрии электронной плотности двойной углерод-углеродной связи является высокий барьер вращения относительно этой связи. Известны, например, два симметрических дидейтероэтилена, резко отличающиеся по своим спектральным характеристикам и другим физическим свойствам:

Эти два пространственных изомера превращаются друг в друга при температуре порядка 450 – 500ºС, что соответствует энергии активации взаимопревращения цис↔транс порядка 65 ккал/моль. Переходное состояние этой реакции изомеризации имеет скрученную структуру, в которой p-орбитали обоих атомов углерода взаимно перпендикулярны.

Две формы дидейтероэтилена представляют собой частный случай общего явления стереоизомерии, называемой цис-транс-изомерией. Две формы дидейтероэтилена могут быть превращены друг в друга с помощью вращения относительно двойной связи таким же образом, как превращаются друг в друга анти- и гош-конформеры бутана при вращении вокруг ординарной C2 – C3-связи:

Однако барьер вращения вокруг двойной связи в дидейтероэтилене составляет 65 ккал/моль, тогда как энергетический барьер интерконверсии анти- и гош-форм бутана составляет всего около 4 ккал/моль. Поэтому оба стереоизомера дидейтероэтилена совершенно стабильны даже при 100ºС, в то время, как анти- и -гош-формы бутана перестают превращаться друг в друга только при –230ºС. Это различие в интерконверсии обусловлено различными видом стереоизомерии и имеет поэтому различные обозначения. Анти- и гош-формы бутана называются конформационными изомерами, а два изомерных дидейтероэтилена называют конфигурационными изомерами.