Галогенирование гомологов метана также является цепным радикальным и его механизм мало отличается от механизма галогенирования самого метана, однако при галогенировании пропана, бутана и других алканов всегда образуется смесь не только продуктов полигалогенирования, но и смесь изомерных продуктов замещения одного атома водорода на галоген. Самыми слабыми связями с наименьшей энергией являются в алканах связи C – C, а не связи C – H. Тем не менее, радикальные реакции замещения в алканах приводят почти исключительно к разрыву связи C – H. Это обусловлено тем, что углеродные цепи в алканах пространственно блокированы связями C – H, поэтому атакующий атом или радикал образует новую связь с атомом водорода, а не углерода. Атаку по углероду, таким образом, затрудняют пространственные препятствия. Но это не означает, что абсолютно все реагенты всегда атакуют алканы по связи C – H. В реакциях с ионными реагентами (см. разд. 4.4.10) главную роль играют полярные, а не пространственные эффекты.
В пропане не все атомы водорода эквивалентны. Шесть из них принадлежат двум первичным атомам углерода, а два других – вторичному атому углерода. На основании чистой статистики при монохлорировании пропана следовало бы ожидать распределение изомерных 1-хлорпропана и 2-хлорпропана в соотношении 3:1. Действительно, при 500ºС соотношение этих продуктов близко к 3:1. Однако при более низких температурах наблюдается иное соотношение изомеров. Так, например, в растворе в неполярном CCl4 при хлорировании пропана при 25ºС, индуцируемом облучением, образуется смесь 43% 1-хлорпропана и 57% 2-хлорпропана:

Это означает, что избирательность замещения под действием атомарного хлора растет при понижении температуры. Энергия связи C – H для вторичного атома углерода CH2-группы пропана на 3 ккал/моль ниже, чем энергия C – H-связи для первичного атома углерода CH3-группы. Поэтому замещение при вторичном углеродном атоме идет с более высокой скоростью, чем при первичном. Но в пропане имеется шесть равноценных атомов водорода при двух первичных атомах углерода и только два атома водорода при вторичном углероде. Относительная реакционная способность двух различных C – H-связей может быть выражена следующим образом:
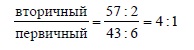
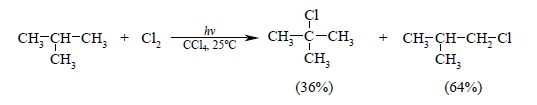
В тех же условиях 2-метилпропан образует 36% 2-хлор-2-метилпропана (трет-бутилхлорида) и 64% 1-хлор-2-метилпропана:
Это соответствует реакционной способности третичной C – H-связи относительно первичной C – H-связи, как 5:1:
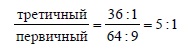
Таким образом, реакционная способность атомов водорода при различных типах атомов углерода уменьшается в ряду третичный > вторичный > первичный, и селективность хлорирования зависит от температуры:
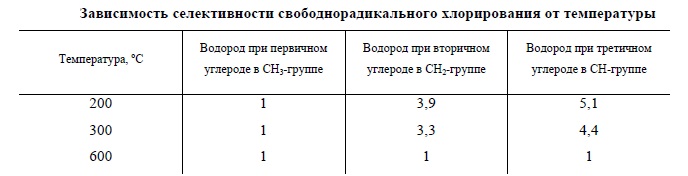
Селективность свободнорадикального хлорирования алканов в целом невысока, и этот метод чрезвычайно редко применяется в лабораторных условиях для получения индивидуальных алкилгалогенидов, но он применяется в промышленности для получения смеси алкилгалогенидов, а из них – смеси спиртов. Исключение составляет хлорирование углеводородов, при котором невозможно образование изомерных продуктов, например:
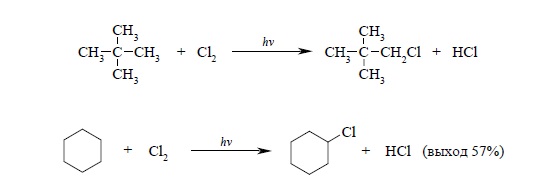
Бромирование алканов – намного более селективный процесс, чем хлорирование. Так, например, при бромировании н-пропана в газовой фазе при 330ºС получается 92% 2-бромпропана и только 8% 1-бромпропана:
![]()
Тепловой эффект для первой стадии развития цепи двух этих конкурирующих процессов достаточно сильно различается:

Высокая селективность при бромировании алканов проявляется особенно явно в том случае, когда атом водорода находится при третичном атоме углерода. Так, например, 2,2,3-триметилбутан при бромировании дает более 97% третичного алкилгалогенида, несмотря на то, что на один атом водорода при третичном углероде приходится пятнадцать атомов водорода при первичных атомах углерода:
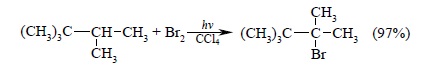
Селективность бромирования алканов при 200ºС составляет 1 для CH3-группы; 90-100 – для вторичной CH2-группы и 1600 – для третичной CH-группы.
В реакциях свободнорадикального хлорирования и бромирования алканов реализуется общая для органических реакций закономерность: более активный агент (Cl•) менее селективен, а менее активный агент (Br•) более селективен.
Более высокую избирательность атома брома по сравнению с атомом хлора можно объяснить с помощью постулата Хэммонда (см. гл. 3, разд. 3.4.5). Первая стадия развития цепи при хлорировании пропана экзотермична (ΔHº = -5 ккал/моль), тогда как первая стадия развития цепи при бромировании пропана эндотермична (ΔHº = +10 ккал/моль). Следовательно, энергия активации для бромирования должна быть выше, чем для хлорирования. Согласно постулату Хэммонда, для эндотермического процесса переходное состояние по энергии и структуре подобно продуктам реакции, в экзотермическом процессе переходное состояние по структуре напоминает исходные реагенты. Сходство переходного состояния эндотермической реакции с продуктами должно включать в себя энергетическое различие в термодинамической стабильности продуктов реакции, откуда следует, что эндотермические реакции более селективны.


