Присоединение бромистого водорода к алкенам резко отличается от присоединения остальных галогеноводородов – HF, HCl и HI. В зависимости от условий при присоединении HBr к несимметричным алкенам образуются продукты присоединения или в соответствии с правилом Марковникова, или против правила Марковникова. До 1933 г. причины этой аномалии были совершенно не ясны, и результату различных групп исследователей по присоединению HBr находились в резком противоречии друг с другом. Нередко конечным продуктом оказывалась смесь обоих изомерных бромидов. Так, например, при присоединении бромистого водорода к бромистому аллилу (2-бромпропену) в присутствии следов воздуха образуется смесь 1,2- и 1,3-дибромпропанов или даже преимущественно 1,3-дибромпропан: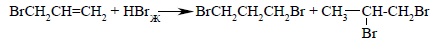
Рациональное объяснение аномального присоединения бромистого водорода к алкенам было дано М. Карашем и Ф. Майо в 1933 г. Они обнаружили, что при полном отсутствии кислорода в исходных реагентах и растворителе гидробромирование алкенов строго подчиняется правилу Марковникова и, следовательно, осуществляется по механизму электрофильного присоединения по двойной связи, описанному в предыдущих разделах этой главы. В присутствии кислорода или различных перекисных добавок, таких как перекись бензоила,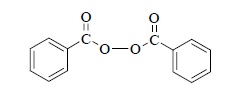
гидроперекись трет-бутила (CH3)3C – O – OH, H2O2 и т.д., механизм реакции изменяется с электрофильного на радикальный, что приводит к полному изменению региоселективности гидробромирования алкена, которое теперь происходит против правила Марковникова:![]()
Присоединение бромистого водорода, инициируемое кислородом или перекисями, осуществляется по цепному радикальному механизму. Инициирование радикальной цепи заключается в образовании атома брома, который вызывает развитие радикальной цепи:
Радикальное присоединение к алкенам
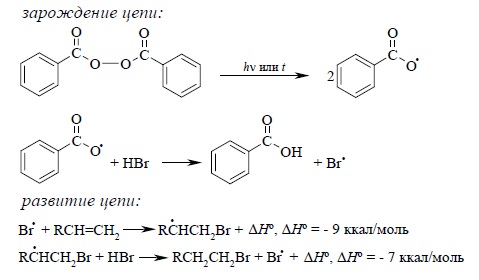
Образование радикала Br• при зарождении цепи происходит в результате взаимодействия кислорода или, что более эффективно, перекисного радикала с бромистым водородом. С чисто энергетической точки зрения образование C6H5COOH и Br• гораздо выгоднее, чем образование C6H5COOBr и H•, поскольку энергия связи O – H значительно превышает энергию связи O – Br, и, следовательно, в радикальном процессе образование C6H5COOH и Br• предпочтительнее. Обе стадии развития цепи экзотермичны и характеризуются низкой энергией активации, что облегчает развитие цепного процесса. Атом брома присоединяется к концевому атому углерода алкена с образованием наиболее замещеного вторичного радикала. Аналогично карбокатионам вторичные алкильные радикалы стабильнее первичных (гл. 4). Поэтому в первой стадии развития цепи образуется только вторичный радикал R•CHCH2Br, но не первичный радикал RCHBrCH2•. В конечном итоге это приводит к антимарковниковскому продукту радикального гидробромирования RCH2CH2Br. Это не должно вызывать удивления, если принять во внимание, что радикал брома в этой реакции выполняет ту же роль, что и протон в реакции электрофильного присоединения галогеноводородов к алкенам:
Аномальное гидрогалогенирование, инициируемое перекисями, характерно для присоединения HBr, но не HCl, HI или HF. Энергия связи C – I настолько мала, что присоединение радикала I• к двойной связи в первой стадии развития цепи эдотермично и требует высокой энергии активации:![]()
хотя вторая стадия развития цепи экзотермична:![]()
При радикальном присоединении HCl и особенно HF к двойной связи, напротив, вторая стадия развития цепи характеризуется поглощением тепла, поскольку энергия связи HCl очень высока (103,2 ккал/моль):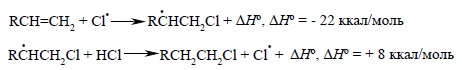
Цепные радикальные процессы осуществляются легко только в том случае, когда обе стадии развития радикальной цепи экзотермичны. Наличие эндотермичной стадии соответствует медленной и обратимой реакции с быстрым обрывом цепи. Поэтому в обычных условиях радикальное присоединение HF, HBr и HI к двойной связи не происходит.
Ряд других соединений с подходящей энергией связи могут присоединяться к двойной связи по радикальному механизму, подобному радикальному присоединению HBr к алкенам. Известны многочисленные примеры присоединения к алкенам сероводорода, тиолов, дисульфидов, четыреххлористого и четырехбромистого углерода, CBrCl3: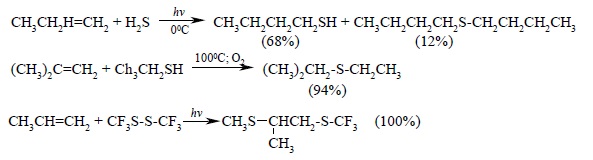
CCl4 и CBr4 легко реагируют с алкенами в присутствии перекисей, иницирующих радикальные процессы, с образованием аддуктов состава 1:1.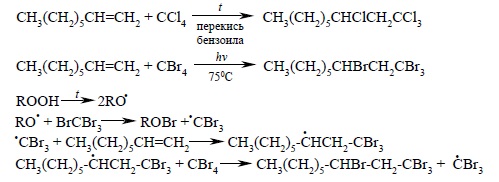
В некоторых случаях, особенно для самого этилена, такие реакции приводят к сложной смеси продуктов так называемой теломеризации, где промежуточно образующийся радикал присоединяет одну за другой несколько молекул этилена: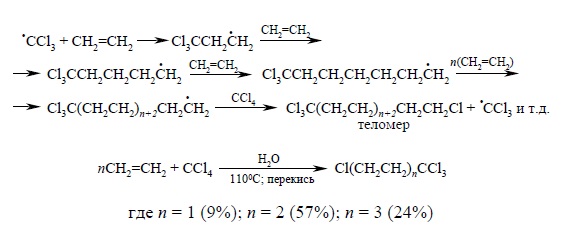
В процессах теломеризации преобладают продукты со сравнительно низкой молекулярной массой, соответсвующей низким значениям n < 5 вследствие легкости обрыва радикальной цепи.