Взаимодействие ковалентных сульфенгалогенидов (старое название – сульфенилгалогениды) RSCl и RSBr с алкенами длительное время считалось одной из самых простых AdE-реакций алкенов. Присоединение сульфенгалогенидов дает β-галогентиоэфиры с выходами, близкими к количественному. При этом не наблюдается образованием продуктов сопряженного присоединения растворителя, даже уксусной кислоты или ацетонитрила, и не осуществляются скелетные перегруппировки, Стереохимия реакции присоединения RSCl и RSBr практически всегда соответствует анти-присоединению групп RS- и галогена, а ее региоселективность – преимущественному антимарковниковскому присоединению для терминальных алкенов (1-алкенов):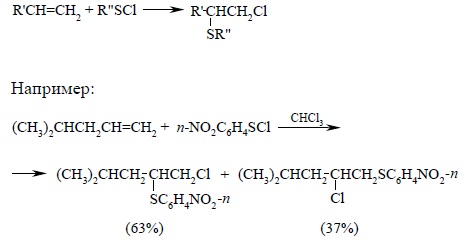
Для замещенных стиролов, однако, присоединение сульфенгалогенидов протекает в полном соответствии с правилом Марковникова.
Для этой реакции без серьезной аргументации был предложен механизм с участием мостикового эписульфониевого иона: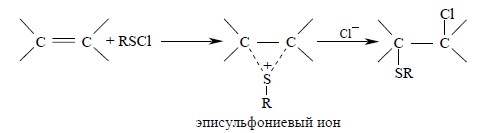
С точки зрения общей методологии изучения AdE-процессов, такие особенности, как отсутствие сопряженного присоединения растворителя и скелетных перегруппировок, а также антимарковниковская ориентация, должны были бы скорее рассматриваться как серьезные аргументы против образования мостикового катиона. Эти представления о механизме присоединения сульфенгалогенидов к алкенам были подвергнуты критике в работах Н.С. Зефирова и В.А. Смита. Они показали, что при присоединении к двойной связи ионно построенного реагента RS+BF4- или RS+SbF6- действительно образуется истинный эписульфониевый ион, который гладко раскрывается при действии самых разнообразных нуклеофильных агентов, таких как уксусная кислота, воды, спирты, тиолы, ацетонитрил и др. Раскрытие эписульфониевого иона происходит в строгом соответствии в правилом Марковникова, т.е. нуклеофильный агент Nu: атакует более замещенный атом углерода: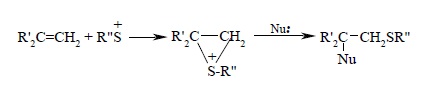
Присоединение RSCl и трет-бутилэтилену характеризуется полным отсутствием скелетных перегруппировок, единственным продуктом реакции является (CH3)3CCH(SR)CH2Cl. В противоположность этому при присоединении RS+BF4- к трет-бутилэтилену происходит 1,2-сдвиг метильной группы, характерный для реакции электрофильного присоединения других реагентов – хлора, галогеноводородов, воды. Присоединение RSCl и RSBr к цис- и транс-изомерам бутена-2, гексена-3 и других алкенов происходит стереоспецифично в широком интервале температур от –40 до +150ºС, тогда как при присоединении катиона RS+ уже при +20ºС происходит стереоконверсия, и образуется смесь трео- и эритро-продуктов присоединения: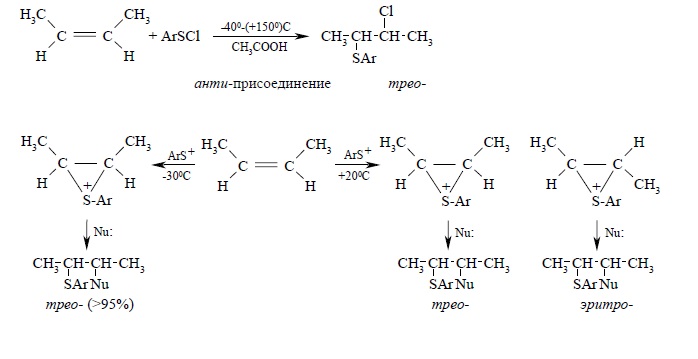
Присоединение сульфенгалогенидов к алкенам в присутствии LiClO4 характеризуется теми же особенностями (перегруппировки, сопряженное присоединение, присоединение по правилу Марковникова), что и присоединение иона RS+. Влияние перхлората лития на стереохимию и направление присоединения сульфенхлоридов получило название «допинг-эффекта». Таким образом, присоединение ионного SR+X- и ковалентного реагентов к двойной связи осуществляется по различным механизмам и эписульфониевый ион в качестве интемедиата получается только при присоединении ионного реагента. Для наиболее полного описания механизма присоединения как ионных (RS+), так и ковалентных (RSCl) реагентов Н.С. Зефировым и В.А. Смитом была предложена общая схема, предполагающая образование в качестве интермедиатов различных типов ионных пар, эписульфониевого иона и ковалентного сульфурана: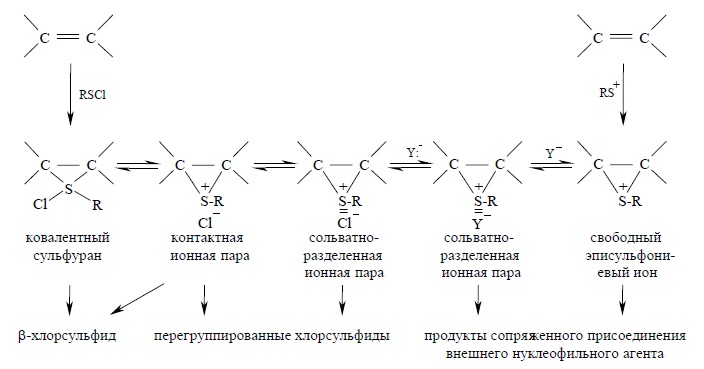
Эта схема, в сущности, является расширенным приложением схемы Уйнстейна для описания реакций мономолекулярного нуклеофильного замещения SN 1-типа у насыщенного атома углерода (гл. 9). Приведенные выше даные по присоединению катиона RS+ и сульфенгалогенидов находятся в хорошем соответствии с последовательностью превращений, предполагаемой в данной схеме. Будущие исследования покажут, можно ли с ее помощью описывать закономерности, наблюдающиеся при присоединении к кратной связи других ковалентных электрофильных агентов – галогенов, галогеноводородов, R2PCl, RSeCl в неполярной и малополярной среде. Вполне возможно, что анти-присоединение неполярных ковалентных хлора или бром к алкенам в неполярных растворителях (CCl4, CHCl3) осуществляется по механизму, в котором галогенониевый ион в качестве интермедиата вообще не образуется, а анти-присоединение достигается с участием интергалогенида типа Haln, где n=4,6 или даже восьми атомам галогена. Для приготовления галогеноводорода в малополярной среде это практически эквивалентно механизму без образования дискретного карбокатиона.