Механизм, который был рассмотрен для хлорирования метана, справедлив и для реакций с другими галогенами. Хлорирование, бромирование, йодирование, фторирование метана — это цепной радикальный процесс, инициируемый гомолизом молекулы галогена с образованием атома галогена. Как и следовало ожидать, реакционная способность уменьшается в ряду F2 > Cl2 > Br2 > I2. Энтальпии последовательных стадий галогенирования (хлорирование, бромирование, йодирование, фторирование метана) метана до CH3X приведены в табл.

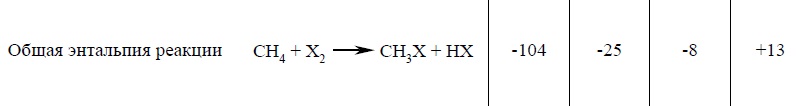
Как видно из данных таблицы, относительная реакционная способность галогенов согласуется как с суммарным значением ΔHº всего процесса галогенирования в целом, так и со значением ΔHº для стадии развития цепи. Это обычный результат для радикальной реакции в газовой фазе. Огромный суммарный тепловой эффект экзотермического фторирования и большие отрицательные энтальпии на каждой стадии развития цепи свидетельствуют о том, что эту реакцию очень трудно контролировать. Энергия образования новой связи значительно превышает энергию разрыва связей в исходных реагентах. Энергия образования связи для HF так велика (166 ккал/моль) по сравнению с другими галогеноводородами, что даже такая необычная реакция фтора с метаном, приводящая сразу к двум радикалам CH3• и F•, эндотермична всего на 6 ккал/моль:
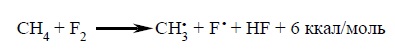
Следовательно, при смешивании метана и фтора в газовой фазе радикалы могут образовываться спонтанно, минуя стадию инициирования цепи:
![]()
Последующие стадии роста цепи настолько экзотермичны, что это приводит к быстрому росту общего количества свободных радикалов фтора вследствие очень малой энергии связи F – F. Накопление радикалов фтора происходит быстрее, чем их расходование, что неизбежно приведет в взрыву. Поэтому прямое фторирование алканов невозможно практически осуществить действием элементарного фтора. Эту трудность можно обойти, если использовать сильно разбавленные газовые смеси фтора и алкана в инертном газе и смешивать их постепенно, однако такой процесс слишком дорог и сложен в технологическом отношении. Фторпроизводные углеводородов составляют важный в практическом отношении класс соединений. Многие фторхлорпроизводные низших алканов под общим названием фреоны используются в качестве хладагентов в различных холодильных установках, обеспечивая требуемых температурный режим в очень широком диапазоне температур. Фреоны широко используются также в качестве абсолютно инертных растворителей, особенно для реакций, протекающих при низкой температуре*. Самый важный из фреонов – CF2Cl2 – получил торговое название фреон-12; CCl3F – фреон-11; CClF2CClF2 – фреон-114; CCl2F2CClF2 – фреон-113; CHClF2 – фреон-22. При пиролизе CHClF2 (фреона-22) образуется тетрафторэтилен CF2=CF2, при полимеризации которого получается полимер фторопласт-4 (тефлон) – исключительно важный и абсолютно инертный полимерный материал.
Перфторалканы используются для разделения изотопов урана-235 и урана-238 в виде летучих гексафторидов 235UF6 и 238UF6. Гексафториды урана разделяют, используя небольшую разницу в скоростях диффузии через мембраны. Гексафториды урана обладают очень высокой коррозионной способностью. Поэтому мембраны, смазочные масла и теплоносители должны обладать высокой коррозионной стойкостью. Пригодными для этой цели оказались только фторсодержащие полимеры и перфторалканы. Перфторалканы получают фторированием алканов под действием фторида кобальта (III). Через слой CoF3 пропускают пары алкана, при этом образуется перфторалкан и фторид кобальта (II).
Фторид кобальта (III) регенерируют, пропуская через CoF2 ток фтора.
Бромирование метана менее экзотермично, чем хлорирование. Первая стадия развития цепи характеризуется высоким эндотермическим эффектом: ΔHº1 = +16 ккал/моль (при хлорировании ΔHº1 = +1 ккал/моль). Это означает, что свободная энергия активации ΔG1≠ для данной стадии бромирования метана должна быть намного выше, чем для хлорирования. Действительно, ΔG1≠ для первой стадии развития цепи (18 ккал/моль; рис. 4.6) при бромировании намного превышает ΔG1≠ для хлорирования (4 ккал/моль). Тепловые эффекты второй стадии развития цепи при бромировании (- 24 ккал/моль) и при хлорировании (- 26 ккал/моль)весьма близки и энергия активации ΔG2≠ для обоих процессов тоже очень мало различаются. Значительно более высокое значение ΔG1≠ для бромирования указывает на то, что бромирование метана протекает с меньшей скоростью, чем хлорирование. Йодирование метана идет с ничтожно малой скоростью даже при 300 – 500ºС и поэтому практически неосуществимо. Чрезвычайно низкая скорость йодирования определяется энергией активации первой стадии развития цепи: ΔG1≠ = 34 ккал/моль. Такое высокое значение ΔG1≠ не удивительно, поскольку первая стадия роста цепи йодирования сильно эндотермична (ΔHº1 = +33 ккал/моль). Поэтому концентрация атомов йода, обладающих энергией, необходимой для преодоления первого энергетического барьера, ничтожно мала даже при 300ºС. При более высоких температурах образующийся HI легко восстанавливает CH3I обратно до CH4 и I2.
Сопоставление значения энтальпии для каждой стадии галогенирования метана, а также сопоставление значений энергии активации ΔG1≠ и ΔG2≠ обеих стадий развития цепи приводит к выводу, что скорость всего процесса определяется скоростью первой стадии роста цепи, имеющей наиболее высокое значение ΔG1≠. Этот вывод остается в силе для любого галогена и любого алкана. Приведенные в этом разделе данные по энтальпиям реакции и энергиям активации галогенирования метана выявляют определенно выраженную закономерность: чем выше положительная энтальпия каждого процесса, тем выше его энергия активации. Этот важный вывод может быть расширен и для многих других гомолитических реакций в газовой фазе или в неполярной среде, что позволяет прогнозировать скорость такого рода реакций только на основании теплового эффекта реакции.