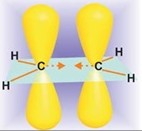
Гидрирование алкинов происходит примерно в тех же условиях и в присутствии тех же катализаторов, что и гидрирование алкенов. Первая стадия гидрирования ацетилена до этилена более экзотермична, чем вторая, где этилен превращается в этан:
Из этих данных следует, что гидрирование алкинов, в принципе, можно остановить на стадии образования алкена. Однако с большинством катализаторов алкины гидрируются прямо до алканов:![]()
Тем не менее, можно подобрать условия таким образом, чтобы остановить гидрирование на первой стадии. Катализатором восстановления алкинов до алкенов служит палладий на карбонате кальция, дезактивированный обработкой ацетатом свинца (катализатор Линдлара), или другая его разновидность – палладий на сульфате бария, дезактивированный хинолином. Гидрирование алкинов на катализаторе Линдлара происходит стереоселективно с образованием цис-алкенов. Стереохимическая чистота цис-алкенов в этом случае не превышает 96%, т. е. наряду с цис-алкеном всегда получается 5-10% транс-изомера. В качестве наиболее типичного примера приведем гидрирование ацетиленового спирта до цис-алкенола – ключевой стадии в синтезе половых аттрактантов насекомых, например полового феромона капрового жука – 14-метил-8Z-гексадецен-1-аля: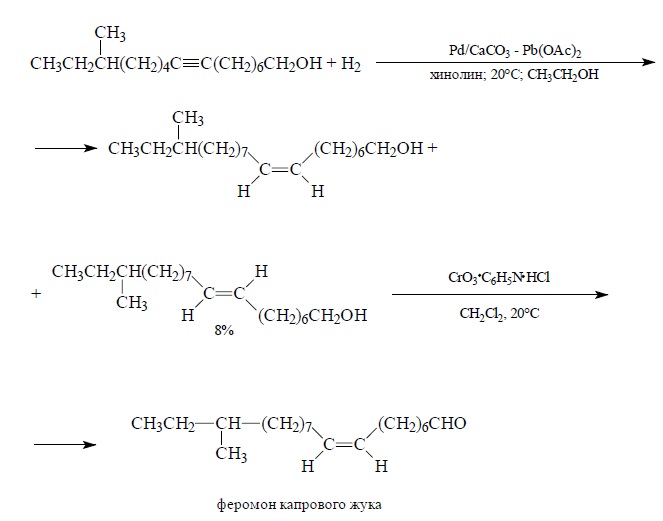
Доля транс-изомера уменьшается до 5% при гидрировании при –30°С и возрастает до 20% при гидрировании при +50°.
Другим интересным примером избирательного восстановления тройной связи на катализаторе Линдлара является гидрирование цис-циклодека-1-ен-6-ина, где двойная связь не затрагивается:
Для стереоспецифического восстановления диалкилацетиленов до цис-алкенов очень удобным и доступным реагентом оказался диизобутилалюминийгидрид (i-C4H9)2AlH, сокращенно называемый ДИБАЛ-Н:
Так, например, при восстановлении диклододецина с помощью ДИБАЛ-Н образуется исключительно цис-изомер циклододецена: Селективное восстановление тройной связи до двойной объясняется тем, что алкены очень медленно восстанавливаются ДИБАЛ-Н до алканов при 70–80 °С, тогда как восстановление алкинов до цис-алкенов осуществляется уже при 0°. ДИБАЛ-Н получается в промышленности при взаимодействии очень чистого порошкообразного алюминия, водорода и 3-изобутилалюминия. 3-изобутилалюминий получают из изобутилена и водорода:
Селективное восстановление тройной связи до двойной объясняется тем, что алкены очень медленно восстанавливаются ДИБАЛ-Н до алканов при 70–80 °С, тогда как восстановление алкинов до цис-алкенов осуществляется уже при 0°. ДИБАЛ-Н получается в промышленности при взаимодействии очень чистого порошкообразного алюминия, водорода и 3-изобутилалюминия. 3-изобутилалюминий получают из изобутилена и водорода: Для получения из алкина олефина цис-конфигурации 98–99% стереохимической чистоты в качестве катализатора гетерогенного гидрирования следует использовать коллоидальный никель (коммерческое название Р-2-Ni). Такой катализатор получается в результате восстановления ацетата никеля в спирте в присутствии 1,2-этилендиамина H2NCH2CH2NH2, который препятствует дальнейшему гидроборованию алкена до алкана:
Для получения из алкина олефина цис-конфигурации 98–99% стереохимической чистоты в качестве катализатора гетерогенного гидрирования следует использовать коллоидальный никель (коммерческое название Р-2-Ni). Такой катализатор получается в результате восстановления ацетата никеля в спирте в присутствии 1,2-этилендиамина H2NCH2CH2NH2, который препятствует дальнейшему гидроборованию алкена до алкана: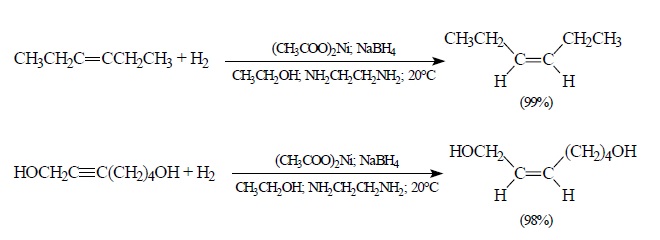
транс-Изомеры алкенов получаются при восстановлении нетерминальных алкинов раствором натрия или лития в жидком аммиаке при –33°С. Растворы щелочных металлов в жидком аммиаке обладают свойствами сильного восстановителя (см. гл. 12) в отличие от амидов щелочных металлов, играющих роль очень сильного основания. Восстановление алкинов натрием в жидком аммиаке притекает полностью стереоспецифично с образованием только транс-изомера. Для этого процесса предложен механизм двухэлектронного восстановления тройной связи с образованием в качестве интермедитов последовательно анион-радикала, винил-радикала и винил-аниона. Первый электрон направляется на разрыхляющую π-орбиталь с образованием анион-радикала. Далее анион-радикал протонируется аммиаком и дает винильный радикал, который присоединяет еще один электрон с образованием винил-аниона. В конце концов винил-анион отщепляет протон от аммиака, выполняющего роль N–H кислоты, в результате чего получается транс-алкен и имид-анион:
Стереохимия конечного продукта восстановления, по-видимому, определяется восстановлением винил-радикала до винил-аниона в стадии (3). Винил-радикал существует в цис- и транс-формах, которые находятся в равновесии, где в сильной степени преобладает транс-форма. Обе формы восстанавляваются до цис- и транс-винил-анионов с примерно равной скоростью, но преобладающей формой оказывается транс-винил-анион, который получается при одноэлектронном восстановлении преобладающего транс-винил-радикала. Взаимопревращение цис- и транс-форм происходит медленно, и скорость этого превращения много меньше скорости протонирования аниона аммиаком в стадии (4).
В качестве примера восстановления алкинов натрием в жидком аммиаке приведем восстановление децина-5 до транс-децена-5 с выходом 78% и стереохимической чистотой 100%.
Аналогично восстанавливаются стеароловая кислота до эландиновой кислоты и длины до транс-, транс-диенов:
Восстановление дизамещенных при тройной связи алкинов до транс-алкенов под действием раствора натрия в жидком аммиаке широко используется в синтезе биологически активных соединений. В качестве примера приведем синтез полового феромона вредителя канадской ели:
Исходным веществом служит 10-бромдеканол-1, в котором гидроксильную группу защищают с помощью дигидропирана, превращая ее в тетрагидропирановый простой эфир (гл. 11). Конденсация защищенного бромгидрина с 1-бутиниллитием в ГМФТА приводит к дизамещеному при тройной связи алкину. Тетрагидропиранильная защитная группа удаляется действием HCl в метаноле, а ацетиленовый спирт далее восстанавливается натрием в жидком аммиаке до алкенола транс-конфигурации. Окисление первичной спиртовой группы до альдегида хлорхроматом пиридиния (гл. 11) завершает синтез полового феромона вредителя ели.
Восстановление алкинов до транс-алкенов стереохимической чистоты 97–98% может быть осуществлено также с помощью алюмогидрида лития в диглиме при 140-150 °С: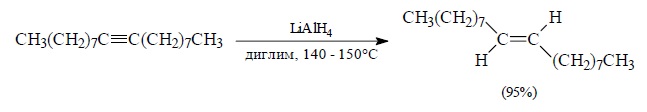
Следует отметить, что алкены не восстанавливаются ни раствором щелочного металла в жидком аммиаке, ни алюмогидридом лития.