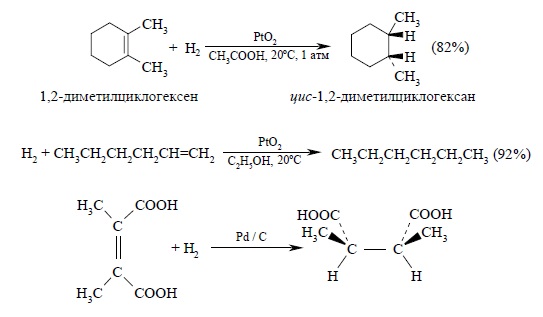
Несмотря на то, что гидрирование этилена и всех других алкенов до алканов сопровождается выделением тепла, эта реакция с достаточной скоростью идет только в присутствии определенных катализаторов. Катализатор, по определению, не влияет на тепловой эффект реакции и его роль сводится к понижению энергии активации. Следует различать гетерогенное и гомогенное каталитическое гидрирование алкенов. В гетерогенном гидрировании используются тонкоизмельченные металлические катализаторы — платина, палладий, рутений, родий, осмий и никель либо в чистом виде, либо нанесенные на инертные носители – BaSO4, CaCO3, активированный уголь и т.д. Все они нерастворимы в органических средах и действуют как гетерогенные катализаторы. Наибольшую активность среди них проявляют рутений и родий, но наибольшее распространение получили платина и никель. Платину обычно применяют в виде черного диоксида PtO2, широко известного под названием «катализатор Адамса». Диоксид платины получают при сплавлении платинохлористоводородной кислоты H2PtCl6•6H2O или гексахлорплатината аммония (NH4)2PtCl6 с нитратом натрия. Гидрирование алкенов с катализатором Адамса проводят обычно при нормальном давлении и температуре 20– 50ºС в спирте, уксусной кислоте, этилацетате. При пропускании водорода двуокись платины восстанавливается непосредственно в реакционном сосуде до платиновой черни, которая и катализирует гидрирование. Другие более активные металлы платиновой группы используют на инертных носителях, например, Pd/C или Pb/BaSO4, Ru/Al2O3, Rh/C и др. Палладий, нанесенный на уголь, катализирует гидрирование алкенов до алканов в спиртовом растворе при 0 – 20ºС и нормальном давлении. Никель обычно используется в виде так называемого «никеля Ренея». Для получения этого катализатора сплав никеля с алюминием обрабатывают горячей водной щелочью для удаления почти всего алюминия и далее водой до нейтральной реакции. Катализатор имеет пористую структуру и поэтому называется также скелетным никелевым катализатором. Типичные условия гидрирования алкенов над никелем Ренея требуют применения давления порядка 5 – 10 атм. и температуры 50 – 100ºС, т.е. этот катализатор значительно менее активен, чем металлы платиновой группы, но более дешев. Ниже приведены некоторые типичные примеры гетерогенного каталитического гидрирования ациклических и циклических алкенов:
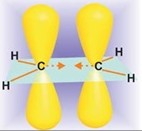
Так как оба атома водорода присоединяются к атомам углерода с двойной связью с поверхности металла-катализатора, обычно присоединение происходит с одной стороны двойной связи. Этот тип присоединения называется син-присоединением. В тех случаях, когда два фрагмента реагента присоединяются с различных сторон кратной связи (двойной или тройной), имеет место анти-присоединение. Термины син- и анти- по смыслу эквивалентны терминам цис- и транс-. Чтобы избежать путаницы и недоразумений, термины син- и анти- относятся к типу присоединения, а термины цис- и транс- — к строению субстрата (алкена).
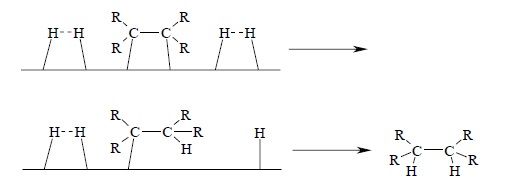
Хотя многие важные детали еще неясны, достигнуто общее понимание механизма и стереохимии сложного процесса каталитического гидрирования. Водород адсорбируется на поверхности металлического катализатора. Кратная углерод-углеродная связь также взаимодействует с поверхностью металла, образуя сложные интермедиаты, в которых органическая молекула сильно адсорбирована. Первоначально образовавшийся интермедиат адсорбирован обоими углеродными атомами двойной связи, и π-орбитали алкена использованы для связывания с поверхностью металла. Водород, адсорбированный на поверхности, далее присоединяется к адсорбированной молекуле субстрата, и образующаяся при этом частица связана с поверхностью металла σ-связью. Этот интермедиат далее подвергается гидрогенолизу – расщеплению новой молекулой водорода по связи C – металл с образованием конечного насыщенного продукта. Схематически и упрощенно это может быть представлено следующим образом:
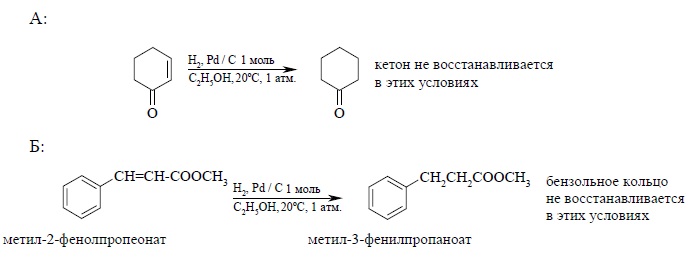
Двойная связь в алкенах гидрируется с большей скоростью по сравнению со многими другими функциональными группами (C=O, COOR, CN и др.) и поэтому гидрирование двойной C=C-связи часто представляет собой селективный процесс, если гидрирование ведется в мягких условиях (0 – 20ºС и при атмосферном давлении. Ниже приведены некоторые типичные примеры:
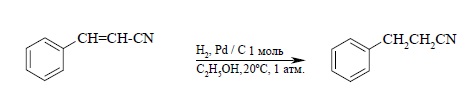
Большим и принципиально важным достижением в каталитическом гидрировании является открытие растворимых комплексов металлов, которые катализируют гидрирование в гомогенном растворе. Гетерогенное гидрирование на поверхности металлических катализаторов имеет ряд существенных недостатков, таких как изомеризация алкена и расщепление одинарных углерод-углеродных связей (гидрогенолиз). Гомогенное гидрирование лишено этих недостатков. За последние годы получена большая группа катализаторов гомогенного гидрирования – комплексов переходных металлов, содержащих различные лиганды. Лучшими катализаторами гомогенного гидрирования являются комплексы хлоридов родия (I) и рутения (III) с трифенилфосфином – трис-(трифенилфосфин)родийхлорид [(C6H5)3P]3RhCl и гидрохлорид трис-(трифенилфосфин)-рутения [(C6H5)3P]3RuHCl. Наиболее доступен родиевый комплекс, который получается при взаимодействии хлорида родия (III) с трифенилфосфином (катализатор Дж. Уилкинсона). Родиевый комплекс Уилкинсона используется для гидрирования двойной связи в обычных условиях:
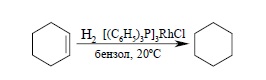
Важное преимущество гомогенных катализаторов заключается в возможности селективного восстановления моно- и дизамещенной двойной связи по сравнению с три и тетразамещенной из-за больших различий в скорости гидрирования. Благодаря этому стало возможно селективное восстановление одной двойной связи в присутствии другой двойной связи в одной и той же молекуле:
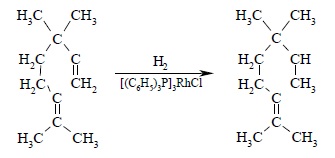
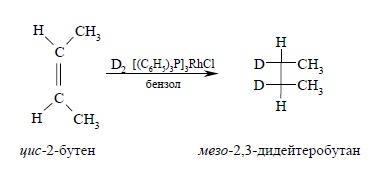
Присоединение водорода происходит в цис-положение, восстановление цис-2-бутена дейтерием приводит к мезо-2,3-дидейтеробутану: